Indledning
Ethvert moderne benzindrevet køretøj indeholder et bemærkelsesværdigt stykke kemisk ingeniørkunst skjult i sit udstødningssystem. Denne enhed, trevejskatalysator, tjener et enkelt, afgørende formål: at neutralisere de mest skadelige forurenende stoffer produceret af en forbrændingsmotor. Uden den ville vores byer være oversvømmet af smog, og luftkvaliteten ville udgøre en betydelig trussel mod folkesundheden. Motorens forbrændingsproces er, selvom den er kraftfuld, ufuldkommen. Den genererer giftige biprodukter som kulilte, uforbrændte kulbrinter og nitrogenoxider. Trevejskatalysatoren fungerer som en sidste forsvarslinje. Den omdanner disse farlige gasser til harmløse stoffer, før de overhovedet når udstødningsrøret. Denne artikel giver en videnskabelig og teknisk udforskning af trevejskatalysatoren. Vi vil undersøge dens historie, dens indviklede kemiske processer, dens fysiske komponenter og de præcise betingelser, der kræves for, at den kan fungere effektivt.
Kapitel 1: Udviklingen fra tovejs- til trevejskonvertere
Rejsen til det moderne trevejskatalysator begyndte med en voksende bevidsthed om luftforurening. I midten af det 20. århundrede identificerede forskere og regulatorer køretøjers udstødning som en primær kilde til bymæssig smog. Den første større lovgivningsmæssige reaktion i USA var Clean Air Act, som gav Miljøstyrelsen (EPA) bemyndigelse til at fastsætte strenge grænser for køretøjers emissioner.
Det første trin: Tovejs oxidationskonvertere
Bilproducenter reagerede i første omgang med den "tovejs" katalysator. Disse anordninger dukkede først op i udbredt omfang på det amerikanske marked i de fleste køretøjer fra modelåret 1975. Deres opgave var at håndtere to af de tre vigtigste forurenende stoffer: kulilte (CO) og uforbrændte kulbrinter (HC).
Disse tidlige konvertere fungerede som oxidationskatalysatorer. Inde i enheden reagerede ilt fra udstødningsstrømmen med CO og HC. Denne kemiske reaktion, accelereret af katalysatorer som platin og palladium, omdannede dem til to langt sikrere forbindelser: kuldioxid (CO₂) og vand (H₂O). Selvom de var effektive til denne specifikke opgave, gjorde tovejskonvertere intet for at håndtere det tredje store forurenende stof: nitrogenoxider (NOx). NOx er en nøgleingrediens i dannelsen af sur regn og ozon ved jordoverfladen.
Den omfattende løsning: Fremkomsten af trevejskonverteren
Efterhånden som reglerne blev strammet, blev behovet for en mere komplet løsning presserende. Ingeniører udviklede "trevejs"-konverteren til at håndtere alle tre klasser af forurenende stoffer samtidigt. Volvo var en pioner og introducerede de første kommercielle trevejskonvertere på sine 1977-køretøjer til det californiske marked, som havde de strengeste emissionslove.
Ved modelåret 1981 krævede føderale bestemmelser betydelige reduktioner i NOx-udledning. Dette mandat gjorde reelt trevejskatalysator en standard og essentiel komponent i alle nye benzindrevne biler i USA. Denne teknologi repræsenterede et stort spring fremad, da den inkorporerede en anden kemisk proces - reduktion - udover oxidation. Denne dobbeltvirkende evne er det, der gør den "trevejs".
Sammenligning: Tovejs vs. trevejs katalysatorer
Sondringen mellem disse to teknologier er fundamental. Tabellen nedenfor viser deres vigtigste forskelle. Moderne køretøjer bruger udelukkende trevejskonvertere for at opfylde omfattende globale emissionsstandarder.
| Funktion | Tovejs katalysator | Trevejs katalysator |
|---|---|---|
| Behandlede forurenende stoffer | Kulilte (CO), Kulbrinter (HC) | Kulilte (CO), kulbrinter (HC), nitrogenoxider (NOx) |
| Primær kemisk proces | Oxidation | Oxidation og reduktion |
| Anvendte katalysatormetaller | Platin (Pt), Palladium (Pd) | Platin (Pt), Palladium (Pd), Rhodium (Rh) |
| Primær funktion | Omdanner CO til CO₂ og HC til CO₂ + H₂O | Udfører de samme oxidationsreaktioner plus reducerer NOx til N₂ |
| Moderne applikation | Forældet i benzinbiler; brugt i nogle diesel- og lean-burn-applikationer | Standard på stort set alle moderne benzindrevne køretøjer |
Kapitel 2: Kernekemien i en trevejskatalysator
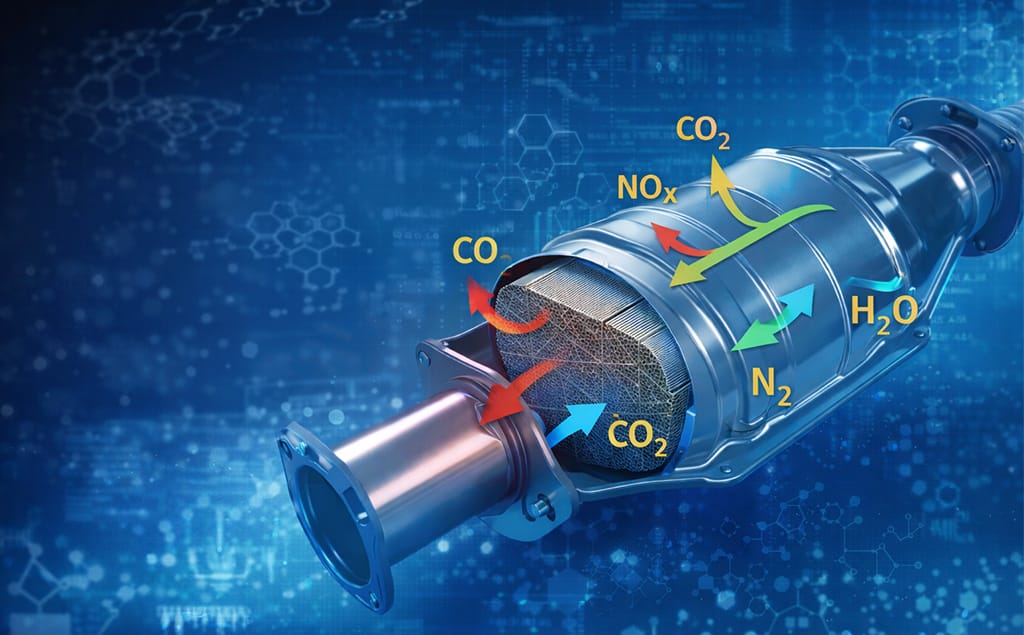
EN trevejskatalysator er i bund og grund en kemisk reaktor. Den bruger specifikke materialer, kendt som katalysatorer, til at fremskynde kemiske reaktioner uden at blive forbrugt i processen. Navnet "trevejs" angiver dens evne til at fremme tre samtidige kemiske transformationer. Disse reaktioner er grupperet i to forskellige processer: reduktion og oxidation.
Disse to processer foregår i separate trin eller på forskellige katalysatormaterialer i konverterhuset. For at begge kan fungere effektivt, skal motorens computer opretholde en meget præcis balance mellem brændstof og luft.
Reduktionsreaktionen: Neutralisering af nitrogenoxider (NOx)
Det første trin i omdannelsen er rettet mod de vanskeligste forurenende stoffer, nitrogenoxider (NOx). Denne familie af gasser dannes, når nitrogen og ilt reagerer under højt tryk og høje temperaturforhold inde i en motors cylindre.
Reduktionskatalysatoren er ansvarlig for at nedbryde NOx. Rhodium (Rh) er det foretrukne ædelmetal til denne opgave. Det har en unik evne til at fjerne iltatomer fra nitrogenoxidmolekyler. Denne reaktion frigør nitrogenatomerne, som derefter binder sig til hinanden og danner harmløs nitrogengas (N₂), den primære komponent i den luft, vi indånder.
- Kemisk reaktion: 2NOx → xO₂ + N₂
I denne reaktion letter rhodiumkatalysatoren nedbrydningen af NOx til elementært ilt og stabil nitrogengas.
Oxidationsreaktionen: Oprensning af CO og HC
Det andet trin håndterer kulilte (CO) og uforbrændte kulbrinter (HC). Kulilte er en giftig gas, der stammer fra ufuldstændig brændstofforbrænding. Kulbrinter er simpelthen rå, uforbrændte brændstofpartikler.
Oxidationskatalysatoren bruger den ilt, der frigøres under reduktionsfasen, sammen med alt andet tilgængeligt ilt i udstødningen, til at omdanne disse to forurenende stoffer. Platin (Pt) og palladium (Pd) er de primære metaller, der anvendes i denne proces. De fremmer reaktioner, der tilfører ilt til CO- og HC-molekylerne.
- Kulilteoxidoxidoxidation: 2CO + O₂ → 2CO₂
- Kulbrinteoxidation: CₓH₂ₓ₊₂ + [(3x+1)/2]O₂ → xCO₂ + (x+1)H₂O
Denne proces omdanner giftig kulilte til ikke-giftig kuldioxid (CO₂) og omdanner forurenende kulbrinter til kuldioxid og vanddamp (H₂O).
Oversigt over kemiske transformationer
Tabellen nedenfor opsummerer de tilførte forurenende stoffer og deres outputprodukter efter passage gennem en trevejskatalysator.
| Inputforurenende stof | Kemisk formel | Reaktionstype | Katalysatormetal | Outputprodukt | Kemisk formel |
|---|---|---|---|---|---|
| Kvælstofoxider | NOx | Reduktion | Rhodium (Rh) | Kvælstofgas | N₂ |
| Kulilte | CO | Oxidation | Platin (Pt), Palladium (Pd) | Kuldioxid | CO₂ |
| Kulbrinter | HC | Oxidation | Platin (Pt), Palladium (Pd) | Kuldioxid og vand | CO₂ og H₂O |
Kapitel 3: Anatomi af en trevejskatalysator
Selvom kemien er kompleks, er den fysiske struktur af en konverter designet til maksimal effektivitet og holdbarhed. Den består af tre primære komponenter, der arbejder sammen: substratet, washcoaten og katalysatorlaget.
Underlaget: Et fundament med maksimalt overfladeareal
Kernen i konverteren er substratet. Dette er en keramisk monolit, typisk lavet af cordierit, eller nogle gange en metallisk struktur. Det er ikke en solid blok, men en indviklet bikagestruktur. Dette design har tusindvis af små parallelle kanaler.
Formålet med bikagen er at maksimere det overfladeareal, der kommer i kontakt med udstødningsgasserne. Et større overfladeareal muliggør mere effektive og hurtigere kemiske reaktioner inden for et kompakt fysisk rum. Tætheden af disse kanaler, målt i celler pr. kvadrattomme (CPSI), kan variere. Højtydende applikationer kan bruge en højere CPSI for bedre konvertering, mens standardkøretøjer bruger en balance mellem effektivitet og flow.
Underlagsmaterialet skal have flere nøgleegenskaber:
- Højtemperaturmodstand: Den skal kunne modstå udstødningstemperaturer på over 1200 °C (2200 °F).
- Termisk stabilitet: Den bør ikke revne eller deformeres under hurtige temperaturændringer.
- Strukturel styrke: Den skal modstå de konstante vibrationer og tryk fra udstødningssystemet.
- Lav pris: Producenter skal producere det økonomisk i masseskala.
Vaskecoaten: Forøgelse af den reaktive overflade
Selve det keramiske substrat er ikke katalytisk aktivt. For at forberede det til ædelmetallerne påfører producenterne en "washcoat". Dette er et lag af porøst materiale, oftest aluminiumoxid (Al₂O₃), der påføres hele den indre overflade af bikagestrukturen.
Washcoatens funktion er at øge det effektive overfladeareal dramatisk på mikroskopisk niveau. Dens ru, porøse tekstur skaber utallige kroge og sprækker, hvor katalysatorpartiklerne kan forankres. Dette øger de tilgængelige reaktive steder eksponentielt, hvilket gør konverteren langt mere effektiv, end hvis metallerne blev påført direkte på den glatte keramik.
Ædelmetallerne: Det katalytiske kraftværk
Det sidste og mest afgørende lag indeholder selve katalysatorerne. Disse er ædelmetallerne fra platingruppen: Platin (Pt), palladium (Pd) og rhodium (Rh)Et meget tyndt lag af disse metaller er bundet til overfladen af washcoaten.
- Platin (Pt) er en fremragende oxidationskatalysator, der er yderst effektiv til at omdanne både CO og HC.
- Palladium (Pd) fungerer også som en oxidationskatalysator og bruges ofte som et billigere alternativ eller supplement til platin.
- Rhodium (Rh) er den dedikerede reduktionskatalysator. Dens eneste formål er at nedbryde NOx.
Den høje pris på disse metaller er den primære årsag til, at trevejskatalysatorer er værdifulde og et hyppigt mål for tyveri. Bilproducenter forsker konstant i nye måder at reducere mængden af ædelmetal, der er nødvendigt (en proces kaldet "genbrug") uden at gå på kompromis med konverteringseffektiviteten.
Kapitel 4: De kritiske betingelser for optimal ydeevne
EN trevejskatalysator fungerer ikke med maksimal effektivitet under alle forhold. To faktorer er absolut afgørende for dens funktion: luft-brændstofforholdet og driftstemperaturen. Køretøjets motorstyringssystem er omhyggeligt designet til at kontrollere disse to variabler.
Det støkiometriske luft-brændstofforhold: En delikat balance
For at konverteren kan udføre både reduktions- og oxidationsreaktioner effektivt, skal motoren køre ved eller meget tæt på det støkiometriske luft-brændstofforhold. For benzin er dette forhold cirka 14,7 dele luft til 1 massedel brændstof (14,7:1).
- Hvis blandingen er for fed (for meget brændstof), vil der ikke være nok ilt tilgængelig til at oxidere CO og HC fuldstændigt.
- Hvis blandingen er for mager (for meget luft), vil den overskydende ilt hæmme reduktionen af NOx, da rhodiumkatalysatoren ikke vil være i stand til effektivt at fjerne ilt fra NOx-molekylerne.
Det "sweet spot" for en trevejskatalysator er et meget smalt vindue omkring dette støkiometriske punkt. For at opretholde denne balance bruger køretøjer et lukket feedbacksystem. Iltsensorer (eller O2-sensorer) placeret i udstødningsstrømmen før og efter konverteren måler konstant iltindholdet. Disse data føres tilbage til motorstyringsenheden (ECU), som foretager realtidsjusteringer af brændstofindsprøjtningen for at holde luft-brændstofforholdet perfekt afbalanceret.
Lys-slukketemperaturen: Behovet for varme
Katalysatorer kræver en minimumstemperatur for at blive kemisk aktive. Dette kaldes "light-off"-temperaturen, som typisk ligger mellem 250 °C og 300 °C (482 °F og 572 °F). Under denne temperatur gør konverteren meget lidt for at rense udstødningen.
Derfor er et køretøjs udledning højest under en "koldstart". Når motoren starter første gang, er udstødningen og konverteren kolde. Det kan tage flere minutters kørsel, før konverteren når sin slukningstemperatur. I denne opvarmningsperiode passerer ubehandlede forurenende stoffer direkte ud af udstødningsrøret.
For at bekæmpe dette problem har ingeniører udviklet flere strategier:
- Tætkoblede katalysatorer (CCC): Dette indebærer at placere en mindre, foreløbig katalysator meget tættere på motorens udstødningsmanifold. Ved at være tættere på varmekilden kan den nå sin slukningstemperatur meget hurtigere, ofte på under 20 sekunder.
- Elektrisk opvarmede katalysatorer (EHC): Nogle avancerede systemer bruger et elektrisk varmeelement til at forvarme konverteren før eller umiddelbart efter motorstart. Dette kan reducere kulbrinteudledningen betydeligt ved koldstart.
Kapitel 5: Bredere effekt og moderne anvendelser
De trevejskatalysator er mere end blot en komponent i en bil; det er en grundlæggende teknologi for global miljøbeskyttelse. Dens udbredte anvendelse har været direkte ansvarlig for massive reduktioner i luftforurening i byer over hele verden.
Ud over almindelige personbiler er denne teknologi tilpasset til en bred vifte af anvendelser, der bruger forbrændingsmotorer. Dette omfatter:
- Lastbiler og busser
- Motorcykler
- Gaffeltrucks og minedriftsudstyr
- Elektriske generatorer
- Lokomotiver og marinefartøjer
- Selv nogle avancerede brændeovne til at kontrollere partikel- og gasudledning
I hvert tilfælde tilpasses kerneprincipperne for trevejskatalyse for at opfylde specifikke regler og driftsforhold. Den løbende udvikling af denne teknologi er drevet af gradvist strengere emissionsstandarder, såsom Euro-standarderne i Europa og Tier-standarderne fastsat af EPA i USA.
Konklusion
De trevejskatalysator er en ubesunget helt inden for moderne bilteknologi. Det er et sofistikeret kemisk forarbejdningsanlæg i miniature, der udfører en kompleks ballet af reduktions- og oxidationsreaktioner. Ved at udnytte kraften fra platin, palladium og rhodium omdanner det en giftig strøm af motorudstødning til stort set uskadelige gasser. Dets udvikling var en direkte og effektiv reaktion på en voksende miljøkrise. Mens transportens fremtid måske ligger i elbiler, vil forbrændingsmotoren forblive udbredt i årtier fremover. Så længe den gør det, vil den løbende forbedring og anvendelse af trevejskatalysatoren være afgørende for at beskytte den luft, vi indånder, og vores planets sundhed.